

En la última entrega para Biotech Magazine & News hicimos una breve introducción sobre la estructura del genoma del coronavirus pandémico y la ubicación de sus muchas mutaciones (sustituciones, deleciones e inserciones). Se fijó el foco en la espiga y, más en concreto, en los dominios RBD y NTD, dos territorios genómicos fundamentales por cuanto participan en la unión del virus a los receptores celulares de membrana para su entrada en la célula hospedadora. RBD y NTD acumulan el mayor número de mutaciones en las diferentes variantes víricas. Y además, un hecho de alcance, estos sectores genómicos albergan los antígenos (epítopos) donde se unen los anticuerpos neutralizantes generados tras una infección natural (Covid-19) y los producidos tras el estímulo antigénico provocado por las diferentes plataformas de vacunas (mRNA, adenovirus manipulados o partículas virales).
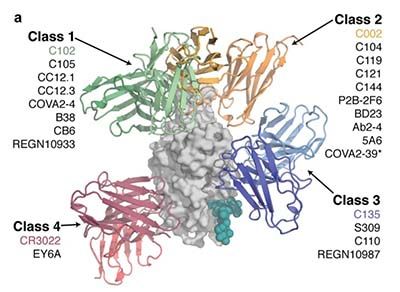
Los anticuerpos neutralizantes (AN) del sitio RBD son de cuatro clases. Se numeran del 1 al 4 (Figura 1) dependiendo del epítopo específico del RBD al que se unen. El NTD también tiene epítopos antigénicos que son dianas de los correspondientes anticuerpos.
Las diversas mutaciones modifican la capacidad del coronavirus para unirse y entrar en las células, incrementar la virulencia y/o modificar la respuesta inmune. Se acepta la gran capacidad expansiva de ómicron: tiene un tiempo de duplicación bajo, el número de reproducción efectivo/Re es alto y hay una concentración vírica muy elevada en los bronquios: 70 veces más que delta (Figura 2), que supera al linaje natural (Wild type) y a la todavía dominante delta. Pero tal vez el punto de mayor interés actual es analizar la respuesta inmune. Está demostrado que ómicron es capaz de infectar a algunas personas que pasaron la infección (reinfecciones) y también a las vacunadas con las pautas oficiales de las plataformas mRNA y de adenovirus modificados (infecciones disruptivas).
El escape o evasión inmune
Por escape inmune se entiende la capacidad que tiene un virus de eludir la respuesta inmunitaria humoral frente a la infección o frente a las vacunas. La evasión inmune es, junto al incremento de la infectividad (contagio) y la virulencia (gravedad), uno de los mecanismos utilizado por los virus para perpetuarse. Las nuevas mutaciones incrementan el espectro del escape inmune. A lo largo de los dos años de pandemia se ha conocido y demostrado el aumento de la transmisión de la variante alfa (B.1.1.7). Esta propiedad puede ir asociada a cierto grado de evasión inmune, como ocurre con la variante delta (B.1.617.2). También han surgido variantes que pueden eludir de forma notable la respuesta inmunitaria (frente a los anticuerpos neutralizantes): es el caso de la variante beta (B.1.351).
Un virus en plena evolución adaptativa, sometido a la presión de la inmunidad grupal y a la producida por las vacunas, las dos in crescendo, además de seguir en plena expansión planetaria hasta ahora de la mano de la variante delta, puede mutar y unir ambas propiedades evolutivas: transmisión aumentada y evasión inmune. Esto se refleja en su perfil mutacional: ómicron tiene 37 (>74%) de sus más de 50 mutaciones totales ubicadas en la proteína S (espiga) y 15 se encuentran en el RBD, el sitio donde se unen los anticuerpos neutralizantes. Nueve de las mutaciones son específicas del RBM (Receptor Binding Motif, aminoácidos S432-T486), el subdominio de RBD que interactúa directamente con el receptor ACE2 de la membrana celular. Además, el RBM es un determinante antigénico mayor. Es decir, es la llave de entrada del coronavirus en la célula hospedadora y también una herramienta vírica de escape.
Los cambios no solo ocurren en los coronavirus humanos
Veintitrés (62,1%) de las 37 mutaciones de la espiga de ómicron se han demostrado en las diferentes variantes de preocupación (VOC), en las variantes de interés (VOI) o en otros coronavirus del género Sarbecovirus, al que pertenece SARS-CoV-2. Lo cual significa que 14 mutaciones (37,8%) de las 37 son nuevas, no descritas antes en ninguno de los linajes conocidos hasta ahora. El hecho no puede ser intrascendente desde el punto de vista evolutivo.
Se ha propuesto que la mutación múltiple de ómicron puede ser debida a: I. Un fenómeno de recombinación genética (intercambio de segmentos genómicos), algo parecido a lo que sucede en las gripes pandémicas (reagrupamiento o mezcla de material genético de dos o más cepas de virus animales y humanos diferentes). II. A una infección crónica en un paciente inmunodeprimido, un fenómeno que puede favorecer la acumulación de mutaciones. Y III. Al intercambio genético entre especies animales diferentes (salto de especie), es decir, una zoonosis desde un animal reservorio (murciélago) o intermediario (mamífero), o una zoonosis reversa desde el ser humano al animal y viceversa, como ocurrió con el espectacular y efímero episodio de los visones de Dinamarca. Dicho de otro modo: no se debe perder de vista que la infección descontrolada en los humanos puede repercutir también en los animales lo que, en reciprocidad, puede repercutir en los humanos.
El estudio de los anticuerpos neutralizantes en la valoración de la inmunidad
El parámetro más utilizado en la investigación de la respuesta natural o vacunal frente al SARS-CoV-2 es la determinación de los anticuerpos neutralizantes. Existen varios tipos de ensayos que miden la cuantía de la respuesta neutralizante (en comparación con la cepa nativa o con otra variante) y permiten comprobar la persistencia en el tiempo (entre 69-173 o 68-202 días, según se analice la neutralización en pseudovirus o en virus vivo). Estos dos interesantes aspectos dominan el debate en los foros científicos y en los medios de comunicación de masas. Hasta el punto de que parece existir una competencia -es indudable su protagonismo en el debate popular- sobre la efectividad de las diversas plataformas vacunales respecto a su potencia neutralizante y a la duración de esta. El asunto se ha complicado aún más con el fenómeno de las variantes virales y su diferente capacidad de evadir la inmunidad humoral.
Breve análisis de la literatura sobre anticuerpos neutralizantes
Cuatro artículos recientes (14 y 15 de diciembre de 2021) y uno de colofón (18 de diciembre) pueden servir de ejemplo por aportar información al respecto. La primera publicación es de W. F. García-Beltrán y colaboradores, un equipo del Massachussets General Hospital (más dos investigadoras de Sudáfrica y Alemania) liderado por Alejandro B. Balazs (MIT y Harvard). Investigan la respuesta de los anticuerpos neutralizantes (AN) frente a tres de las vacunas autorizadas en los Estados Unidos (Pfizer, Moderna y Johnson&Johnson/J&J). Para ello, estudian 239 sujetos (trabajadores sanitarios y residentes en comunidades, con una edad media de 38 años, el 63% mujeres) divididos en tres grupos: 1. Recién vacunados no infectados (pauta oficial puesta menos de tres meses antes); 2. Vacunados hace tiempo y no infectados (vacuna entre 6 y 12 meses); 3. Infectados con vacunación distante (vacuna distante e infección Covid-19 demostrada); y 4. Vacunados con refuerzo y no infectados (dosis de refuerzo en los últimos 3 meses). Es decir, salvo los del grupo 3, los demás no habían sido infectados antes.
La variante ómicron elude las tres vacunas administradas siguiendo la pauta oficial (dos dosis de Pfizer y Moderna y una dosis de J&J). También ómicron se transmite (in vitro) dos veces más que delta y cuatro veces más que la cepa nativa Wuhan-Hu-1. La buena noticia es que el refuerzo vacunal (tercera dosis) logra niveles de anticuerpos neutralizantes protectores contra ómicron. Esto sucede, probablemente, por ampliación de la respuesta inmune y por la existencia de reactividad cruzada. El gran interés del trabajo de García-Beltrán y colaboradores no debe obviar el hecho de que hacen su ensayo con pseudovirus (lentivirus transfectados en células 293T) de la cepa natural (Wild type), delta y ómicron. Esta es una metodología que tiene una excelente correlación con otros modelos, pero trabajar con pseudovirus ómicron puede limitar en parte la investigación, como reconocen los investigadores.
La investigación de los anticuerpos neutralizantes genera discusión entre los expertos porque, además de que se trata de modelos de laboratorio, y no dicen qué sucede en la vida real, todavía siguen comunicándose algunas novedades en la aplicación de las técnicas que pueden alterar los resultados. La información ofrecida por los ensayos de neutralización es excelente y muy necesaria para entender la compleja relación entre los coronavirus y los hospedadores (humanos y animales). Pero la inmunidad frente a los coronavirus no se compone solo de anticuerpos neutralizantes. Es fundamental el papel protagónico de la rama inmunitaria celular (en especial, los linfocitos T), que parece preservada en buena parte y es más duradera que la humoral neutralizante.
Inquieta ver a diario el simplismo dominante en el debate público no cualificado, a nivel de tertulias y de programas de entretenimiento de máxima audiencia. Un fenómeno mediático que sucede a la hora de interpretar y difundir los resultados de las abigarradas investigaciones. En estos escenarios divulgativos, la mayor parte de las veces se hacen análisis superficiales basados en las gráficas de los ensayos científicos exhibidos en las redes sociales. Este hecho puede incrementar la confusión donde ya reina el desconcierto y los mensajes contradictorios por los fallos de comunicación cometidos desde el inicio de la pandemia. El caldo de cultivo ideal para la proliferación parásita de los negacionistas y los antivacunas de perfil pseudocientífico.
En línea con el trabajo de García-Beltrán, pero con un diferente objetivo, Elisabetta Cameronii y colaboradores, al frente de un grupo multinacional (Suiza, Estados Unidos, Pakistán, Argentina, Italia y Australia) en el que figura el español Amalio Telenti, estudian la unión de RBD al receptor ACE2 de ratones, visones americanos y pangolines. Para estudiar la unión al receptor ACE2, usan Surface Plasmon Resonance (SPR), que es una técnica que mide en tiempo real interacciones moleculares, como la unión de un ligando a un receptor. El RBD de ómicron solo se une al ACE2 del ratón, pero no al receptor de los visones americanos, pangolines, ni en las variantes humanas Wuhan-Hu-1, alfa, beta o el RBD de un pseudovirus con la mutación K417N. La diferencia del ratón con otras especies animales es que posee la mutación Q493R, similar a la Q493K aislada tras la adaptación del ratón al SARS-CoV-2. Muy interesante es saber que varias mutaciones disminuyen la unión del RBD de ómicron al ACE2; pero, paradójicamente, su afinidad al receptor es 2,6 veces mayor que la de la cepa nativa. Este hecho sugiere la existencia de epistasis en el total de las mutaciones (epistasis significa que la expresión de un gen se ve afectada por la expresión de uno o más genes heredados de forma independiente). En suma, las mutaciones en el RBD de ómicron se han adaptado al ratón (un aviso sobre futuras zoonosis) y han incrementado la eficacia transmisora en los humanos.
Para conocer la respuesta del plasma policlonal, el grupo de Cameronii analiza el suero de sujetos convalecientes y de receptores de seis vacunas distintas. Los primeros, y los receptores de tres vacunas (dos dosis: Sputnik V y BBIBP-CorV; una dosis: Ad26.COV2. S), muestran niveles inadecuados de AN. Los vacunados con las vacunas mRNA y AZD1222 responden frente a la cepa de pseudovirus D614G, pero muestran menos potencia contra el pseudovirus ómicron (33, 44 y 36 veces menos, respectivamente); sin embargo, los vacunados tras haberse infectado antes tuvieron una respuesta mejor (caída > 5 veces).
La mayoría (26 de 29) de los anticuerpos monoclonales ensayados perdieron actividad neutralizante in vitro contra ómicron. Solo tres de ellos, incluido el S2K146 que imita a ACE2, conservó la potencia inalterada. Una fracción de anticuerpos monoclonales de Sarbecovirus ampliamente neutralizantes que reconocen sitios antigénicos fuera del RBM, incluidos sotrovimab, S2X259 y S2H97, neutralizaron ómicron. La magnitud de la evasión inmune mediada por la variante y la adquisición de la unión a ACE2 del ratón indican que existe un cambio mutacional importante del coronavirus pandémico. Como está dicho, Cameronii et al, como García-Beltrán, para hacer los ensayos de anticuerpos neutralizantes también trabajan con modelos de pseudovirus (en su caso, con el virus de la estomatitis vesicular o VSV manipulado) en cultivos de diferentes líneas celulares (Vero E6, Vero E6/TMPRSS2) y con los linajes Wuhan-Hu-1 y ómicron.
Hasta aquí dos ejemplos de investigación de la capacidad neutralizadora mediante ensayos de pseudovirus. En ambos casos se prueba que la variante ómicron muestra una amplia y potente evasión inmune. Pero, además de los pseudovirus, es interesante ver algún ejemplo de investigación con virus vivos de pacientes infectados naturalmente con ómicron. Cabe preguntarse si estudiar virus auténticos, tanto de la variante ómicron como del linaje comparativo (Wuhan-Hu-1, D614G o delta), permite alcanzar resultados parecidos, iguales o diferentes a los obtenidos con pseudovirus.
Investigación con virus vivos
Delphine Planas, al frente de un grupo investigador franco-belga, estudia un paciente de Bélgica infectado con ómicron muy probablemente adquirido en Egipto. Planas et al (artículo preprint) analizan la respuesta frente a 9 anticuerpos monoclonales comerciales o en investigación. También analizan el comportamiento frente al suero de 36 personas convalecientes de Covid-19 y de un grupo de personas vacunadas pero no infectadas previamente. Los resultados muestran, de modo resumido, que ómicron tuvo total o parcial resistencia a la neutralización de todos los anticuerpos monoclonales. Los sueros de los convalecientes recogidos entre 6 y 12 meses después de la infección natural no mostraron potencia neutralizante apropiada. Por otra parte, los sueros de los vacunados con Pfizer (16 sujetos) y con AstraZeneca/Oxford (18 sujetos) extraído a los 5 meses de la segunda dosis de las vacunas apenas inhibieron ómicron. Hubo neutralización en los 11 sujetos que recibieron una tercera dosis de vacuna (refuerzo o booster) ocho meses tras la segunda dosis oficial y en los vacunados tras haber sido infectados de forma natural (Covid-19). Aunque los títulos de AN fueron de 5 a 31 veces menores contra ómicron que contra la variante delta.
Una segunda publicación, en la misma línea, es la de Liu et al, del grupo chino-americano liderado por el doctor David Ho en el Aaron Diamond HIV Center de Nueva York (David Ho es muy reconocido y respetado por sus investigaciones en VIH/sida). Los investigadores analizan pseudovirus VSV (en células Vero-E6 y HEK293T), pero también virus vivo ómicron, obtenido del tracto respiratorio de un paciente de Hong Kong y propagado en el laboratorio en células Vero E6-TMPRSS2.
En primer lugar, estudian el suero convaleciente de 10 sujetos infectados con la variante D614G (la pariente más cercana de Wuhan-Hu-1) y lo comparan con el pseudovirus B.1.1.529 (ómicron). La respuesta contra la cepa D614G fue potente, pero cayó en más de 32 veces contra el pseudovirus ómicron. Frente a cuatro vacunas (Pfizer, Moderna, AstraZeneca/Oxford y Johnson&Johnson) la respuesta neutralizante fue muy pobre. Las vacunas mRNA (Pfizer y Moderna) muestran una respuesta en la ID50 21 y 8,6 veces menor. Algo similar sucede con las vacunas de adenovirus (AstraZeneca/Oxford y Johnson&Johnson). Los sujetos que recibieron una tercera dosis de refuerzo homóloga (todas mRNA) a los 6 meses mostraron una respuesta 6,5 veces menor que con la cepa D614G.
Como está dicho, estos datos pertenecen al estudio en pseudovirus VSV. Pero al hacer el estudio con virus auténticos (D614G y la variante ómicron) encuentran una menor respuesta en los vacunados con dos dosis (> 6 veces menor) y en los reforzados (> 4,1 veces menor) comparados con la respuesta frente a la cepa D614G. En cuanto al efecto de los anticuerpos monoclonales terapéuticos (individuales o en combinación), al enfrentar las cepas a un panel de 19 anticuerpos autorizados para su uso comercial (o en vías de conseguirlo), 18 (94,7%) fueron ineficaces contra ómicron. Los anticuerpos se dirigen contra la proteína S (espiga): 17 lo hacen en el RBD y 2 en el NTD. Los autores detectan cuatro nuevas mutaciones de la espiga (S371L, N440K, G446S y Q493R) que confieren gran resistencia a la variante poli mutacional. La construcción de un pseudovirus con la mutación R346K, propia de la variante Mu (B.1.621) y presente en el 10% de las muestras de GISAID, añadida a ómicron (pseudovirus B.1.1.529+R346K) permite demostrar que esta forma menor de la variante es totalmente insensible a los anticuerpos monoclonales, mientras que el análisis de pseudovirus de las diferentes variantes (alfa, beta, delta y otras) mostró resistencia solo a los anticuerpos monoclonales de clase 1 y 2 del RBD y a los del ND. Es decir, ómicron tiene mayor evasión inmune.
Las mutaciones de ómicron detectadas no solo invalidan los anticuerpos de clase 1 y 2 del sitio RBD y los del NTD, como es habitual en otras variantes, sino que también muestran una sustancial resistencia a los anticuerpos de las clases 3 y 4 del RBD. Este hecho convierte a ómicron, en palabras de los autores, en la variante más fugitiva o evasora (escapee) de la neutralización proporcionada por los anticuerpos mono y policlonales disponibles en la actualidad en el arsenal preventivo y terapéutico.
Datos sobre ómicron desde Sudáfrica
Raquel Viana y colaboradores, del prestigioso grupo de Tulio de Oliveira, los descubridores de las variantes beta y ómicron en Sudáfrica han publicado en medRxiv (pendiente de publicarse en Nature) su experiencia con la variante B.1.1.529. Destacamos aquí algunos datos de interés extraídos de dicho artículo de última hora (18 de diciembre 2021).
Respecto a la filogenia de ómicron, Viana et al aseguran que no procede de ninguna de las variantes conocidas. Deriva del linaje B.1.1 (clado 20B de Nextstrain) que ha dado lugar a tres subvariantes: B.1/ómicron (el clado principal), B.1.2 y B.1.3. El ancestro más reciente es del 9 de octubre de 2021. El tiempo de duplicación inicial era de 5,1 días (ahora anda por dos o menos días en algunas zonas del planeta) con un número de reproducción efectivo (Re) estimado en 2,74-2,79: cada infectado lo propagaba a casi tres nuevos contactos.
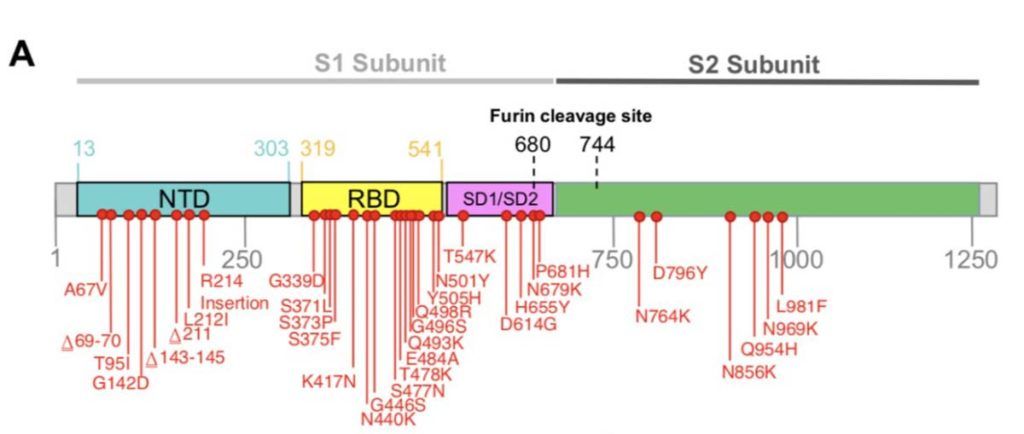
El patrón molecular de la variante prístina muestra 15 mutaciones en RBD (Figura 3, segmento amarillo), cinco de las cuales (G339D, N440K, S477N, T478K, N501Y) aumentan la unión al receptor ACE2 (mayor contagio) y siete (K417N, G446S, E484A, Q493R, G496S, Q498R y N501Y) tienen un moderado impacto en la unión a tres de las cuatro clases de anticuerpos neutralizantes (Figura 1) dirigidos contra los sitios antigénicos del RBD (evasión inmune). Estas mutaciones, junto a cuatro sustituciones, tres deleciones y una inserción en el NTD confieren a ómicron una buena capacidad de eludir la inmunidad natural y por vacunas, además de invalidar el poder bloqueante de gran parte de los anticuerpos monoclonales terapéuticos.
Es muy importante saber que más del 70% de los epítopos de las células B y T no están comprometidos. Es decir, la inmunidad celular es respetada. Por otra parte, ómicron tiene tres mutaciones (H655Y, N679K y P681H) adyacentes al sitio de fusión de la furina S1/S2 (Figura 3, segmento violeta) que pueden contribuir al aumento de la transmisibilidad. Y, fuera del gen espiga S también ocurren cosas: una deleción en la proteína no estructural 6 (nsp6) puede contribuir a la evasión inmune y una doble mutación en la nucleocápside (N) aumenta la infectividad en las células pulmonares humanas.
El análisis genómico en busca de un posible evento recombinante como origen de ómicron no pudo ser demostrado. Raquel Viana et al concluyen que la variante B.1.1529 es producto de una fuerte selección adaptativa y de la epistasis (recordamos su significado: un gen se afecta por la expresión de uno o más genes heredados de forma independiente).
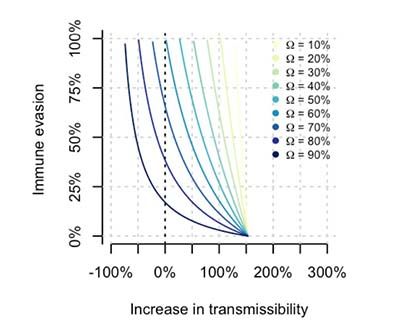
Los autores sudafricanos también analizan la relación entre la transmisibilidad y el grado de inmunidad colectiva en el contexto de la infección por delta (Figura 4). En Sudáfrica, el nivel de inmunidad protectora de la población contra la variante delta es alto. Para los investigadores, la evasión inmunitaria parcial es un factor importante en la dinámica observada de ómicron en Sudáfrica. Este interesante asunto de la transmisibilidad/evasión inmune fue tratado antes (13 de diciembre de 2021) y de forma excelente, en Twitter, por Trevor Bedford.
Conclusión
A partir de los modelos de pseudovirus o de virus vivos utilizados en los ensayos de detección de los anticuerpos neutralizantes, y con el apoyo necesario de argumentos genómicos y epidemiológicos, no cabe duda de que el linaje ómicron (B.1.1.529) es, por méritos propios, muy diferente a las variantes conocidas hasta ahora. Tiene vocación pandémica dentro de la pandemia establecida. Las razones son que se difunde mejor y de un modo más rápido (pronto podrá ser el linaje dominante, compitiendo con delta). También, y sobre todo, porque elude la inmunidad natural (posibilidad de reinfecciones) y de las vacunas (fracaso de las vacunas sin tercera dosis). Pero, hasta que desaparezca totalmente, se amortigüe o conviva con delta, la furia de esta y de otras nuevas variantes posibles (aún hay letras no ocupadas en el alfabeto griego), o bien se disponga de vacunas variante-específicas o, más lejano en el tiempo, se consiga la panacea de una panvacuna eficaz, es razonable decir que la tercera dosis (mejor que refuerzo) de las plataformas mRNA vigentes puede aliviar en la actualidad la gravedad y la incertidumbre del problema.
Por otra parte, y esto se sale del asunto que tratamos, habrá que ver si ómicron no supone un gran paso más hacia la estacionalidad o hacia la endemicidad del SARS-CoV-2 como los cuatros coronavirus respiratorios (su comportamiento recuerda mucho a la gripe pandémica). Sería mucho mejor si, como sus dos parientes epidémicos, se condujera hacia la extinción total (SARS) o casi total (MERS). Sin vacunas.










































