

La enfermedad Covid-19, producida por el coronavirus pandémico SARS-CoV-2, es una afección multisistémica. Su tropismo fundamental, al menos desde el punto de vista de la gravedad de la infección, se ceba con el aparato respiratorio, el sistema nervioso central y el endotelio-vascular. Pero, en verdad, puede afectar a cualquier órgano y aparato. El resultado final depende de diversos factores virales escritos en su genoma y del hospedador (por ejemplo, la distribución y cuantía de los receptores celulares en el organismo).
En cuanto a la expresión clínica de la infección Covid-19, va desde la mayoritaria ausencia o escasez de síntomas (80%) hasta cuadros (respiratorios, vasculares) muy graves (20%) que pueden acabar en la UVI y, con alta probabilidad, provocar la muerte del sujeto infectado. Esta ha sido la tónica general antes de las distribución masiva de las vacunas y se relaciona con la patogenicidad de las diferentes variantes de preocupación del virus (desde la cepa original de Wuhan hasta la más agresiva delta) (Figura 1).
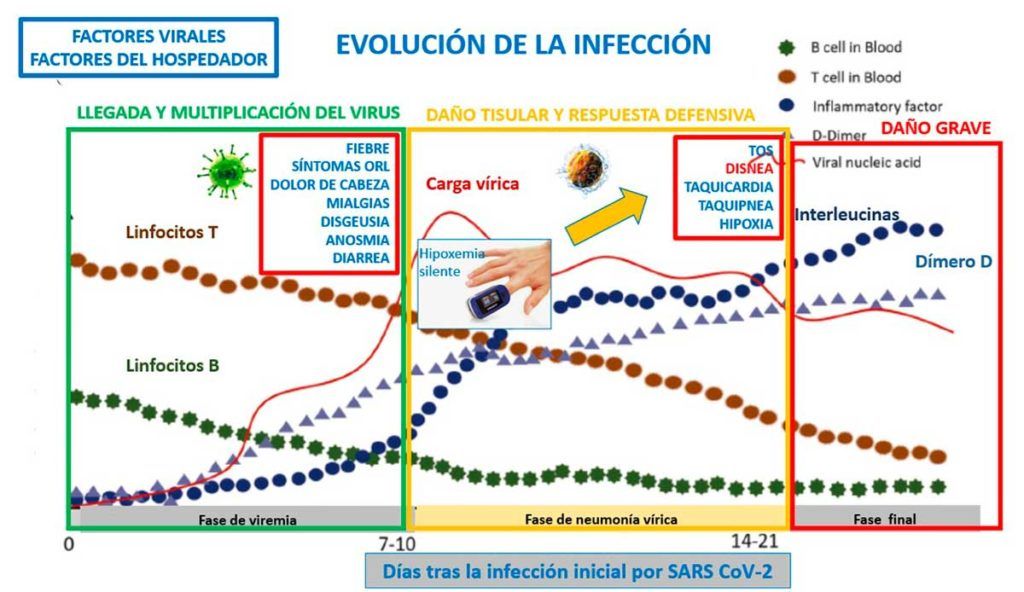
La llegada de la variante ómicron con su familia de subvariantes (BA.1, BA.2 y BA.3), junto a la alta protección inmunitaria natural y vacunal, ha cambiado el panorama epidemiológico y clínico de modo significativo.
En nuestro medio, y en buena parte del planeta, el perfil de la pandemia vigente durante el primer trimestre de 2022 se caracteriza por una espectacular mayor difusión del número de infecciones con una menor gravedad, al menos en las poblaciones vacunadas con tres dosis de las plataformas mRNA (el daño se ceba en los no o incompletamente vacunados). Pero el desastre pandémico no ha acabado aún. Por el contrario, a la luz de lo que está ocurriendo en algunos lugares, parece que estuviera en sus inicios.
Sirva de ejemplo Hong-Kong. En este sentido, es altamente probable que la fatiga pandémica tenga a la ciudadanía harta del virus y de sus consecuencias pero, sin ánimo de interferir con el sentir general, creemos que desde el punto de vista profesional aún no se debe bajar la guardia. Durante su corta biografía, el coronavirus pandémico ha demostrado en varias ocasiones una enorme capacidad de sorprender.
La linfopenia, no es un simple dato del hemograma
Desde el comienzo de la pandemia, que acaba de cumplir dos años tras la proclamación oficial por la OMS (11 de marzo de 2020), un dato analítico llamó la atención de los clínicos asistenciales y de los investigadores: la linfopenia (cifra baja de linfocitos, absoluta y porcentual, en el hemograma) (Figura 1). Al comienzo del problema este dato analítico les pudo parecer a algunos irrelevante por cuanto la linfopenia es un fenómeno común en la mayoría de las infecciones virales (por ejemplo, es paradigmática en la infección VIH/Sida no tratada).
Pero desde 2016 se conocía su importancia patogénica en el MERS (otra forma de infección por coronavirus) como un dato indicativo de apoptosis linfocitaria (muerte celular) y por ser un factor contribuyente a la alta patogenicidad del coronavirus MERS (cuya tasa de mortalidad fue superior al 35%). A medida que aumentó el pico del número de casos de Covid-19 y tras multiplicarse (también de forma exponencial) los estudios epidemiológicos, clínicos, analíticos e inmunológicos se constató que la linfopenia asociada a SARS-CoV-2 no es un simple valor de laboratorio (presente en más del 85% de los pacientes sintomáticos), sino un parámetro hematológico que tenía y tiene una indudable importancia diagnóstica, evolutiva y pronóstica.
En virtud de lo anterior, parece oportuno comentar un artículo reciente (día 11 de marzo de 2022) publicado en Signal Transduction and Targeted Therapy (de Nature) por un grupo de investigadores pertenecientes a diversas instituciones académicas chinas. Los autores analizan la infección por SARS-CoV-2 de los linfocitos de pacientes Covid-19 y de donantes sanos y demuestran que el coronavirus pandémico es el causante de la linfopenia a través de un mecanismo de entrada celular ajeno al receptor ACE2. Un dato a todas luces interesante. Siguiendo la misma secuencia expositiva relatada en el apartado de Resultados del artículo, comentamos los que nos parecen de mayor relevancia.
El coronavirus pandémico infecta los linfocitos de los pacientes con Covid-19
Xu-Rui Sheng et al estudiaron las células de sangre periférica (siglas en inglés, PBC) de 22 pacientes con Covid-19 grave y de 15 donantes sanos. El foco inicial se puso en los linfocitos T (CD4 y CD8), las células B y las células citotóxicas naturales (Natural Killer o NK). Los linfocitos T mostraron valores bajos o muy bajos y casi desaparecieron (valores cerca de cero) en varios pacientes (Figura 2b), mientras que los linfocitos B y NK no se modificaron (Figura 2a).
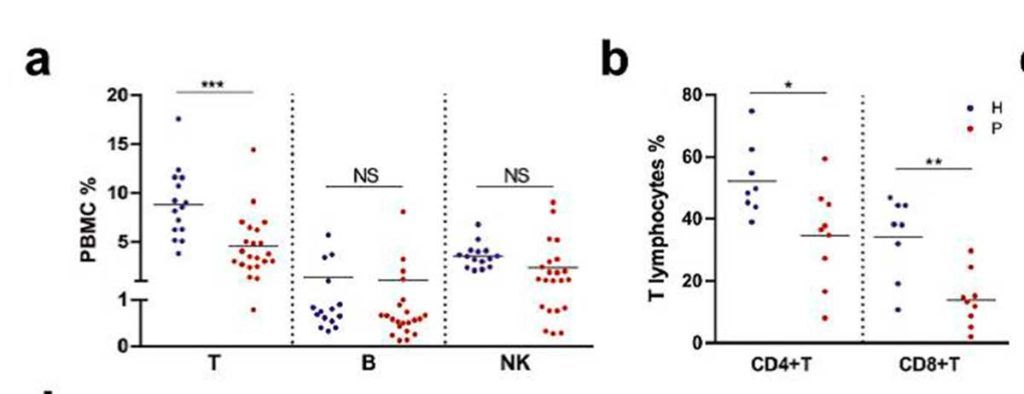
Las células T evidenciaron (por citometría de flujo y por inmufluorescencia) la presencia de antígenos virales (proteína N). Este hecho se demostró tanto en la sangre periférica como en el tejido pulmonar post-mortem de un paciente fallecido por covid-19. El cocultivo de las PBC positivas a antígenos virales con células Caco-2 (línea de células inmortalizadas de adenocarcinoma colorrectal) mostró positividad en el sobrenadante y la presencia de proteína viral en las células Caco-2. Lo cual es evidencia de infección viral activa.
Infección por SARS-CoV-2 de células T in vitro

La detección de ARN viral dirigido al dominio de unión al receptor (RBD) y del ARN subgenómico (sgRNA) dirigido al gen M (Membrana), indicativo de la presencia de células con infección activa, fue positiva en el estudio in vitro. Se infectaron con SARS-CoV-2 dos líneas celulares inmortalizadas de linfocitos T derivados de leucemia (Jurkat y MT4) y linfocitos T primarios de donantes sanos.
El coronavirus pandémico infectó las células Jurkat en modo dependiente del tiempo, siendo la infección más intensa en las células activadas. La microscopía electrónica permitió detectar de forma concluyente las típicas coronas virales distribuidas por el citoplasma linfocitario (Figura 3).
La infección de células de organoide de colon resultó en una infección mucho más efectiva que la existente en las PBC.
Mecanismo de entrada del virus en los linfocitos
Diversos experimentos con las mismas células (Jurkat y MT) permitieron a los investigadores demostrar que la entrada del coronavirus en los linfocitos es independiente del receptor de membrana ACE2 y del correceptor TNMPRSS2, la proteasa dependiente de serina. Como es sabido, estos son los dos puntos más importantes de la interacción coronavirus (proteína S o espiga)-célula hospedadora (receptores y correceptores) y de la entrada celular implicados en la patogenia de la infección por el SARS-CoV-2.
Muerte celular (por apoptosis) de los linfocitos T infectados
Mediante el ensayo TUNEL (un método de análisis in situ para detectar ADN fragmentado durante la apoptosis) los investigadores pudieron demostrar el incremento de la muerte celular (apoptosis) linfocitaria (más de diez veces, comparado con los controles sanos). En algunos pacientes, la mayoría de las células apoptóticas fueron antígeno-positivas (es decir, estaban infectadas por el virus).
En un paciente, se demostró hasta en el 65% de las células apoptóticas. La infección de los linfocitos T de los donantes sanos también mostró apoptosis. La apoptosis fue máxima a las 72 horas. En cuanto al mecanismo patogénico implicado, probablemente está relacionado con la producción de especies reactivas de oxígeno (ROS/Reactive Oxigen Species) mitocondriales.
Busca en las células T de receptores candidatos
El estudio de varios receptores virales permitió descartar a los habituales (ACE2, TMPRSS2) como puerta de entrada del coronavirus en los linfocitos. En cuanto a otros menos conocidos (AXL, NRP1, KIM-1/TIM-1, ASGR1 y KREMEN1), AXL (el receptor de tirosina proteína-quinasa es una enzima codificada por el gen AXL) se expresa en los linfocitos y es un buen candidato, pero su importancia es menor. Sin embargo, no ocurre igual con LFA-1 (Leucocyte Factor Adhesion-1), una molécula de adhesión (integrina) expresada en diversos tipos de leucocitos cuya función es promover el contacto entre dos células o entre una célula y la matriz extracelular. LFA-1 parece ser el factor de adherencia y potencial puerta de entrada para SARS-CoV-2, al menos en las células Jurkat.
Conclusiones: posible futura diana terapéutica
- El coronavirus pandémico SARS-CoV-2 infecta a los linfocitos T.
- Solo afecta a la línea celular T (CD4 y CD8), respetando a los linfocitos B y NK.
- La infección provoca la muerte celular por apoptosis.
- El reflejo clínico de este fenómeno es la linfopenia periférica de linfocitos T.
- La infección linfocitaria ocurre por una vía independiente del receptor ACE2 y del correceptor TMPRSS2.
- La entrada del virus en la célula parece depender de la molécula LFA-1 (Leucocyte Factor Adhesion-1).
- Se desconoce cuál es la proteína de unión entre el SARS-CoV-2 y LFA-1. Este hallazgo induce a pensar en una posible diana terapéutica futura.
- Por otra parte, la infección linfocitaria permite diseminar al virus por todo el organismo. El supuesto mecanismo de entrada celular es compartido por otras células inmunitarias, lo que puede incrementar la repercusión hematológica e inmunológica de la infección.
- Los linfocitos moribundos pueden provocar una respuesta inflamatoria excesiva, empeorando el pronóstico de la enfermedad.
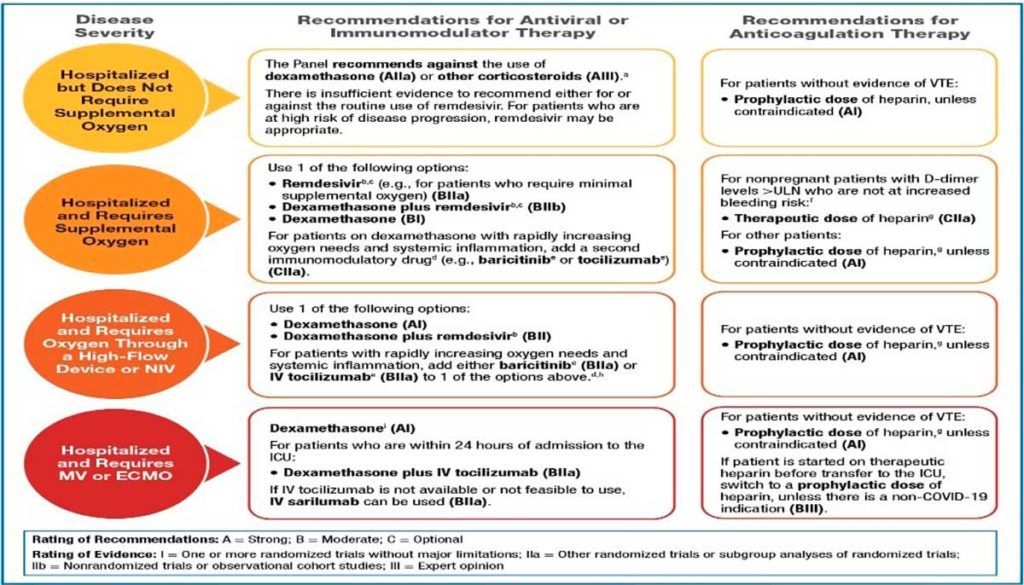
- Se desconoce el mecanismo causal (o los mecanismos causales) de la apoptosis linfocitaria. Además de la infección viral, pueden estar implicados los glucocorticoides endógenos o exógenos. Aunque los autores del artículo no comentan nada al respecto, tal vez este sea un hecho para tener en cuenta a la hora de utilizar dexametasona y otros esteroides en el tratamiento de algunas formas clínicas de Covid-19 (Figura 4).










































