

Al imitar la fotosíntesis, el proceso impulsado por la luz que utilizan las plantas para producir azúcares, un equipo de investigadores del MIT han diseñado un nuevo tipo de fotocatalizador que puede absorber la luz y utilizarla para impulsar una variedad de reacciones químicas.
Conocido como fotocatalizador biohíbrido, contiene una proteína captadora de luz que absorbe y transfiere la energía a un catalizador que contiene metal. Este catalizador utiliza la energía para realizar reacciones que podrían ser útiles para sintetizar productos farmacéuticos o convertir productos de desecho en biocombustibles u otros compuestos útiles.
“Al reemplazar las condiciones y los reactivos dañinos con luz, la fotocatálisis puede hacer que la síntesis de combustibles, agroquímicos y farmacéuticos sea más eficiente y compatible con el medio ambiente”, explica Gabriela Schlau-Cohen, profesora de Química en el MIT y autora principal del estudio que aparece en Chem.
Junto con Paul Cesana y expertos de las universidades de Princeton y Estatal de Carolina del Norte, demostraron que el nuevo fotocatalizador podría aumentar significativamente el rendimiento de las reacciones químicas que probaron. También demostraron que, a diferencia de los fotocatalizadores existentes, su ingenio puede absorber todas las longitudes de onda de luz.
La mayoría de los catalizadores aceleran las reacciones al reducir la barrera de energía necesaria para que ocurra la reacción. En los últimos 20 años, los químicos han logrado grandes avances en el desarrollo de fotocatalizadores que pueden absorber energía de la luz. Esto les permite catalizar reacciones que no podrían ocurrir sin ese aporte extra de energía.
“En la fotocatálisis, el catalizador absorbe energía luminosa para pasar a un estado electrónico mucho más excitado. Y a través de esa energía, introduce una reactividad que sería prohibitivamente intensiva en energía si todo lo que estuviera disponible fuera energía del estado fundamental”, subraya Schlau-Cohen.
Imitando la fotosíntesis
Esto es análogo a lo que hacen las plantas durante la fotosíntesis. La maquinaria fotosintética de las células vegetales incluye pigmentos que absorben la luz, como la clorofila, que capturan fotones de la luz solar. Esta energía luego se transfiere a otras proteínas que almacenan la energía como ATP y esa energía se usa para producir carbohidratos.
En trabajos anteriores sobre fotocatalizadores, los expertos utilizaron una molécula para realizar tanto la absorción de luz como la catálisis. Este enfoque tiene limitaciones, porque la mayoría de los catalizadores utilizados solo pueden absorber ciertas longitudes de onda de luz y no la absorben de manera eficiente.
En este sentido, esta especialista recuerda que “cuando tienes una molécula que necesita hacer la recolección de luz y la catálisis, no puedes optimizar simultáneamente para ambas cosas. Es por eso que los sistemas naturales los separan. En la fotosíntesis, hay una arquitectura dedicada en la que algunas proteínas recogen la luz y luego canalizan esa energía directamente a las proteínas que hacen la catálisis”.
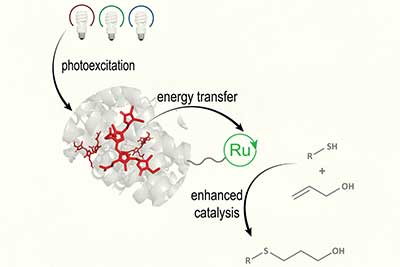
Para crear su nuevo catalizador biohíbrido, los investigadores decidieron imitar la fotosíntesis y combinar dos elementos separados: uno para recolectar luz y otro para catalizar la reacción química. Para el componente de captación de luz, utilizaron una proteína denominada R-ficoeritrina (RPE), que se encuentra en las algas rojas. Unieron esta proteína a un catalizador que contenía rutenio, que se había utilizado anteriormente para la fotocatálisis por sí solo.
Trabajando con investigadores de la Universidad Estatal de Carolina del Norte, dirigidos por el profesor de química Félix Castellano, el laboratorio de la profesora Schlau-Cohen demostró que la proteína recolectora de luz podía capturar la luz de manera efectiva y transferirla al catalizador.
Síntesis química para sintetizar lipopéptidos
Posteriormente, científicos de Princeton, dirigidos por el Nobel David MacMillan, probaron el rendimiento del catalizador en dos tipos diferentes de reacciones químicas. Uno es un acoplamiento tiol-eno, que une un tiol y un alqueno para formar un tioéter, y el otro reemplaza un grupo tiol sobrante con metilo después del acoplamiento del péptido.
El nuevo catalizador biohíbrido podría multiplicar por 10 el rendimiento de estas reacciones, en comparación con el fotocatalizador de rutenio por sí solo.
También encontraron que las reacciones podrían ocurrir bajo iluminación con luz roja, lo que ha sido difícil de lograr con fotocatalizadores existentes y es beneficioso porque produce menos reacciones secundarias no deseadas y es menos dañino para los tejidos, por lo que podría potencialmente usarse en sistemas biológicos.
Según estos investigadores, el fotocatalizador mejorado podría incorporarse en procesos químicos que utilizan las dos reacciones probadas. El acoplamiento de tiol-eno es útil para crear compuestos utilizados en la detección y obtención de imágenes de proteínas, la administración de fármacos y la estabilidad de biomoléculas.
Como ejemplo, se utiliza para sintetizar lipopéptidos que pueden facilitar la captación de candidatos a vacunas antigénicas. La desulfuración de cisteinilo tiene muchas aplicaciones en la síntesis de péptidos, incluida la producción de enfurvitida, un fármaco que podría usarse para tratar el VIH.
Este tipo de fotocatalizador también podría utilizarse para impulsar la reacción despolimerización de lignina para ayudar a generar biocombustibles a partir de madera u otros materiales vegetales que son difíciles de descomponer.
“Hicimos una prueba de principio en la que se puede separar la recolección de luz y la función catalítica. Ahora queremos variar la pieza catalítica y la de recolección de luz para expandir ese conjunto de herramientas, para ver si este enfoque puede funcionar en diferentes disolventes y en distintas reacciones”, detalla la profesora Schlau-Cohen.










































